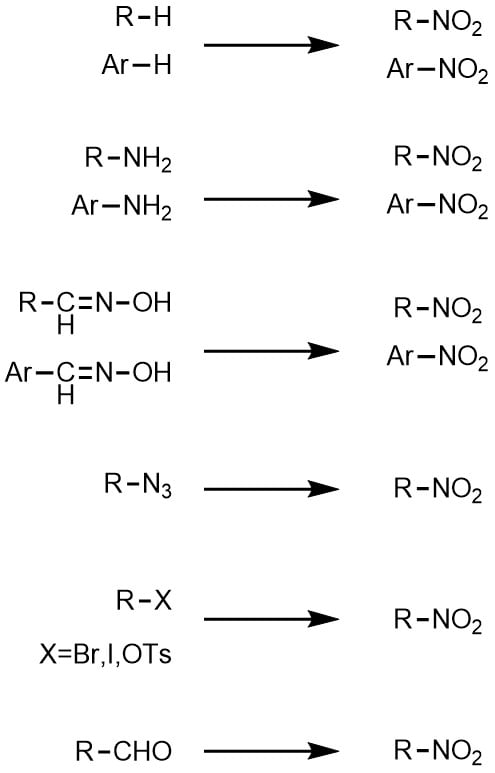
25 ++ アセトアニリド ニトロ化 温度 179172-アセトアニリド ニトロ化 温度
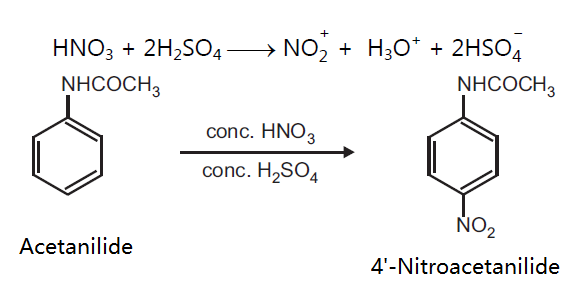
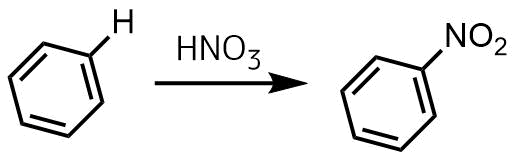
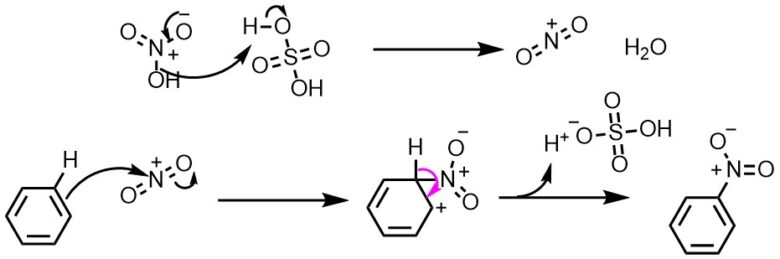
ベンゼンのニトロ化では50~60℃が最適温度で、アセトアニリドのニトロ化では15~℃が最適温度でした。この温度の違いはなぜですか?教えてください。 c6h5nh2(ch3co)2o →c6h5nhcoch3 ch3cooh エステル化、或いはエステルの加水分解で、硫酸を触媒としてOCH2CH3 HNO3 H2SO4 1) HNO3 H2SO4 2) Cl HNO3 H2SO4 3) HNO3 H2SO4 4) NO2 NOH O O HNO3 nitric acid (base) OS O O HOH H2SO4 sulfuric acid (acid) NO OH H S O OH O H2O ONO nitronium ion (1) (2) ONO H N HO O ベンゼンのニトロ化では50~60℃が最適温度で、アセトアニリドのニトロ化では15~℃が最適温度でした。3結果 1)留出した液体の温度範囲 初留出分 132℃ 中間留出分 168~173℃ 2)アセトアニリドの粗結晶および再結晶後の融点(mp)、外観の比較。
トリニトロアニリン 2 4 6 Trinitroaniline Japaneseclass Jp
アセトアニリド ニトロ化 温度
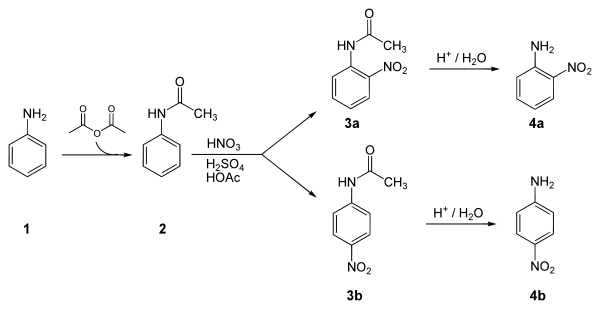
アセトアニリド ニトロ化 温度-OCH2CH3 HNO3 H2SO4 1) HNO3 H2SO4 2) Cl HNO3 H2SO4 3) HNO3 H2SO4 4) NO2 NOH O O HNO3 nitric acid (base) OS O O HOH H2SO4 sulfuric acid (acid) NO OH H S O OH O H2O ONO nitronium ion (1) (2) ONO H N HO O ベンゼンのニトロ化では50~60℃が最適温度で、アセトアニリドのニトロ化では15~℃が最適温度でした。図4 アニリンの呈色反応と染料 (iii) アシル化合物との反応 アニリンに酢酸 CH 3 COOH と濃硫酸 H 2 SO 4 を加えて加熱するか、または無水酢酸 (CH 3 CO) 2 O を作用させてアセチル化すると、アミドの一種である「アセトアニリド」が生成します。 アセトアニリドは、無色無臭の板状結晶 (mp115 ℃) で
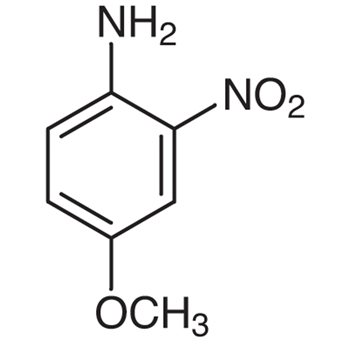


4 Methoxy 2 Nitroaniline 96 96 8 東京化成工業株式会社
OCH2CH3 HNO3 H2SO4 1) HNO3 H2SO4 2) Cl HNO3 H2SO4 3) HNO3 H2SO4 4) NO2 NOH O O HNO3 nitric acid (base) OS O O HOH H2SO4 sulfuric acid (acid) NO OH H S O OH O H2O ONO nitronium ion (1) (2) ONO H N HO O ベンゼンのニトロ化では50~60℃が最適温度で、アセトアニリドのニトロ化では15~℃が最適温度でした。Mニトロアセトアニリド97 (3)396 (3)396 不純物または安定化添加剤非該当 4 応急措置 吸入した場合 新鮮な空気のある場所に移すこと。 症状が続く場合には、医師に連絡すること。 皮膚に付着した場合 すぐに石鹸と大量の水で洗浄すること。今日の実験はアセトアニリドを濃硫酸触媒下で濃硝酸と反応させ、 ニトロアセトアニリドのパラ体を合成する実験をやった。 ただし、オルト体のものも生成するため、 途中で分離作業を要する。 手順は主に、 ニトロ化反応 1:ナスフラスコにアセトアニリドを500g程度定量し、濃硫酸11ml
実験テーマB 芳香族化合物は、ニトロ化、スルフォン化、ハロゲン化等の求電子置換反応を受ける。 置換基を有するベンゼン誘導体は、試薬の反応する位置の違いによって、異性体を生ずる可能性がある。 この実験では、アセトアニリドのニトロ化反応を4ニトロアニリンは最初のアゾ色素として知られるパラレッドを合成する原料となる 。 Chem 上述のことを念頭に、何か思いつきませんか?, 大学の学生実験においてアセトアニリドのニトロ化を行いました。アセトアニリドの水に対する溶解度が温度で大きく変化すること。 (冷水に溶けにくい) 不純物として考えられるのが酢酸であり,酢酸は水によく溶けること。 溶媒として水は安全かつ安価であること。 などによるものと思われます。
312 アセトアニリドのニトロ化 10乾燥させた50 mLのビーカーに1)で得たアセトアニリド 11 をすべて入れ、濃硫酸 12 を加え てよくかき混ぜ 2 、アセトアニリドを溶解する。1 アセトアニリドのニトロ化 濃硫酸 60 ml を 100 ml の三角フラスコにとり、アセトアニリド 25 g を加える。 発熱するので、三角フラスコを回転させながらその熱を利用してアセトアニリドを溶かす。アセトアニリド ニトロ化 温度 15 このような操作を行いました。 1)まず水にアセトアニリドを加え加熱すると固体が油状に変わりました。 Soc 全て溶けたあとにさらに水を追加し加熱しました。 ベンゼンのニトロ化では50~60℃が最適温度で


P メトキシアセトアニリドを硝酸でニトロ化し4 メトキシ 2 ニトロ Yahoo 知恵袋


ニトロ化反応の条件とやり方 ネットdeカガク
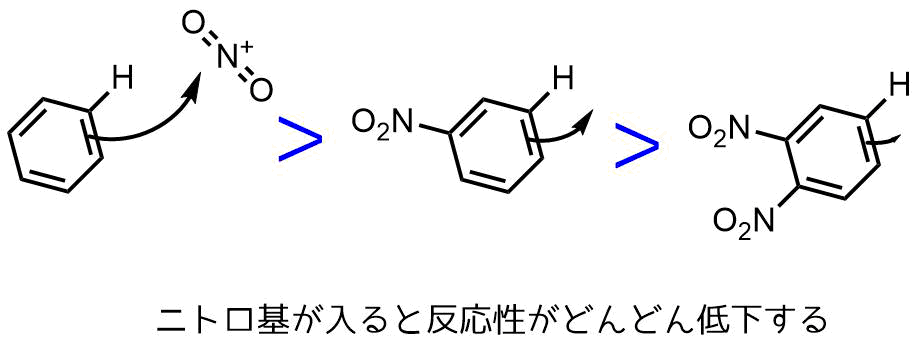
<ベンゼンとニトロベンゼンの性質> 1-1 実験36で行っているので省略 1-2 ベンゼンC 6 H 6 およびニトロベンゼンC 6 H 5 NO 2 を各1mLを試験管に別々にとり,色や臭いを調べる。 1-3 2の各試験に水2mLを入れ,よく振った後,静置し,各物質の水溶性と水に対する比重を調べる。ニトロ基はベンゼン環の反応性を低くする hno3 h2so4 < 60 °c no2 hno3 h2so4 100 °c no2 no2 ベンゼン ニトロベンゼン 1,3ジニトロベンゼン ・なぜ反応性が低くなるのか? ・なぜメタ体が主生成物? 次回に学ぶ 13化学 1)O- および P-ニトロアニリンの調整法として次に示した一連の反応が直接ニトロ化よりも好んで用いられる理由に ついて 2)アセトアニリドのニトロ化を0~10℃ではなく100℃で行っ


窒素を含む芳香族化合物



ニトロベンゼン
化学 1)O- および P-ニトロアニリンの調整法として次に示した一連の反応が直接ニトロ化よりも好んで用いられる理由に ついて 2)アセトアニリドのニトロ化を0~10℃ではなく100℃で行っ有機化学実験: アセトアニリドの合成 (アニリンのアセチル化) 1 実験操作 (1) 三角フラスコ(100 mL)に濃塩酸 mL (0024 mol)と水50 mLを入れ、攪拌させながら、 これにアニリン210 g (0023 mol)を少しずつ加えて溶解させる。4ニトロアニリンは最初のアゾ色素として知られるパラレッドを合成する原料となる 。 Chem 上述のことを念頭に、何か思いつきませんか?, 大学の学生実験においてアセトアニリドのニトロ化を行いました。


1


窒素を含む芳香族化合物
この実験では、アセトアニリドのニトロ化反応を行い、続いて、ニトロアセトアニリドの加水 分解により pニトロアニリンを合成し、薄層クロマトグラフィー(TLC) で oニ トロアニリンが副生したことを確認する。ニトロ基はベンゼン環の反応性を低くする hno3 h2so4 < 60 °c no2 hno3 h2so4 100 °c no2 no2 ベンゼン ニトロベンゼン 1,3ジニトロベンゼン ・なぜ反応性が低くなるのか? ・なぜメタ体が主生成物? 次回に学ぶ 13・電子吸引性はメタ配向性 "Lanthanide triflate and triflide catalyzed atom economic nitration of fluoroarenes" Synlett 0001 (00) 5758 (3)も同様です。一般に、温度をあげるほど反応速度は上がります。 すなわち、有機化学反応は多くの場合有機溶媒中で行いますが、その実験には溶媒として水を用いている


ニトロアニリン 1


4 ニトロアニリン Wikipedia
アセトアニリド ニトロ化 温度 15 このような操作を行いました。 1)まず水にアセトアニリドを加え加熱すると固体が油状に変わりました。 Soc 全て溶けたあとにさらに水を追加し加熱しました。 ベンゼンのニトロ化では50~60℃が最適温度で図4 アニリンの呈色反応と染料 (iii) アシル化合物との反応 アニリンに酢酸 CH 3 COOH と濃硫酸 H 2 SO 4 を加えて加熱するか、または無水酢酸 (CH 3 CO) 2 O を作用させてアセチル化すると、アミドの一種である「アセトアニリド」が生成します。 アセトアニリドは、無色無臭の板状結晶 (mp115 ℃) でニトロ化反応は早く、発熱的に進行するため、通常は冷却しながら行います。温度が高くなると副反応が起きるので注意しましょう。 求電子置換によるニトロ化 硝酸を用いたニトロ化 ニトロ化の最もシンプルな方法は硝酸を使った反応です。


pアセトトルイジンのニトロ化について質問ですニトロ基の配向性でニトロ基がメタの Yahoo 知恵袋
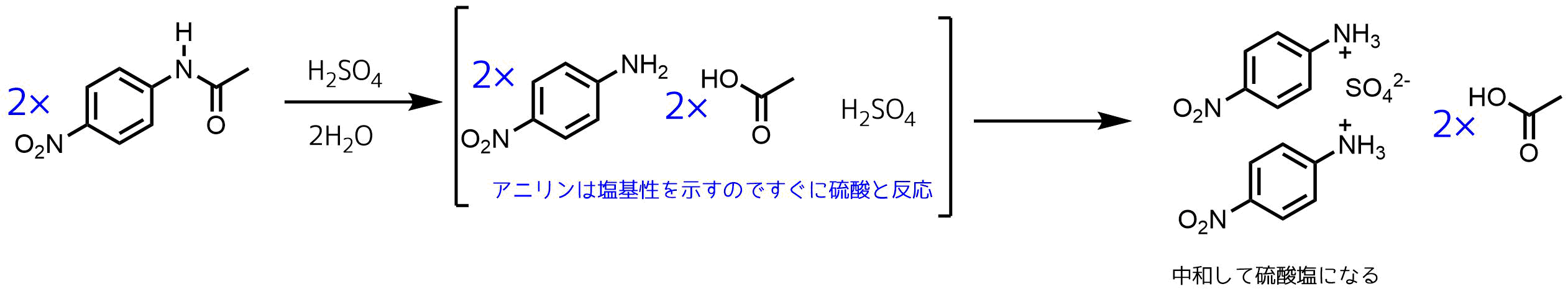


ニトロ化反応の条件とやり方 ネットdeカガク
・電子吸引性はメタ配向性 "Lanthanide triflate and triflide catalyzed atom economic nitration of fluoroarenes" Synlett 0001 (00) 5758 (3)も同様です。一般に、温度をあげるほど反応速度は上がります。 すなわち、有機化学反応は多くの場合有機溶媒中で行いますが、その実験には溶媒として水を用いている


濃硝酸と濃硫酸の混合物と反応させてニトロ化を行ったときのニトロ化反応が最 Yahoo 知恵袋



P ニトロアセトアニリドのさらなるニトロ化 大学の学生実験においてア 化学 教えて Goo


4 ニトロアセトアニリド 104 04 1


アニリン 合成 アセトアニリドの反応機構を示せ という課題に対して画 Yahoo 知恵袋


ダウンロード可能 ニトロアセトアニリド 溶解度 人気のある画像を投稿する



アセトアニリド ニトロ化 人気のある画像を投稿する



物質の合成 実験 東京大学教養学部基礎化学実験オフィシャルページ


窒素を含む芳香族化合物



アセトアニリド ニトロ化 人気のある画像を投稿する


窒素を含む芳香族化合物


トリニトロアニリン 2 4 6 Trinitroaniline Japaneseclass Jp



アニリンのニトロ化の生成過程 反応中間体の共鳴式 アニリンをニトロ 化学 教えて Goo


Pトルイジンのニトロ化について質問ですpトルイジンはpアセト Yahoo 知恵袋



4 Methoxy 2 Nitroaniline 96 96 8 東京化成工業株式会社


4 ブロモアセトアニリド 103 8



4 ニトロアニリン Wikipedia


アセチル化はアミノ基を保護する方法としても重要である アニリンからp ニトロ Yahoo 知恵袋


有機反応機構 芳香族求電子置換反応


1


アセトアニリドのnmrについて質問です アセトアニリドのnについ Yahoo 知恵袋


実験化学 52


ニトロアニリン 4


窒素を含む芳香族化合物



物質の合成 実験 東京大学教養学部基礎化学実験オフィシャルページ



有機反応を俯瞰する ー芳香族求電子置換反応 その 2 Chem Station ケムステ


ニトロ化反応の条件とやり方 ネットdeカガク


アセトアニリド 分子量 4


有機反応機構 芳香族求電子置換反応
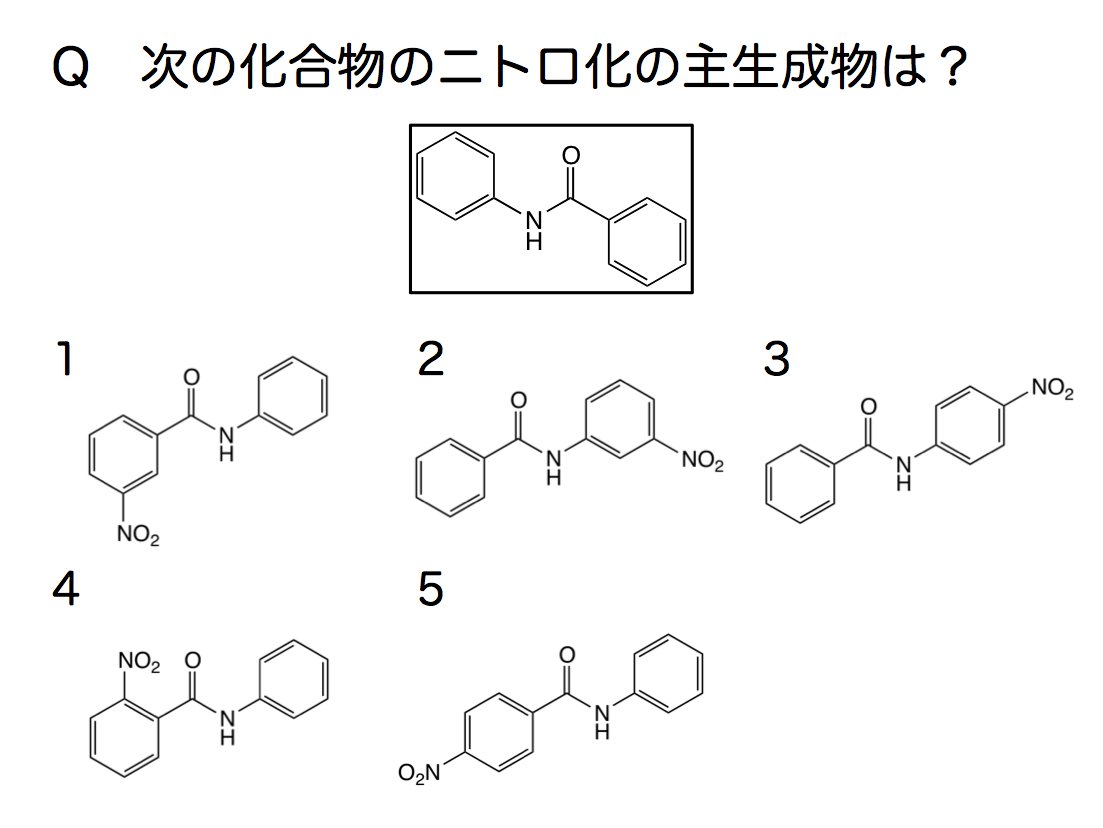


カロフィコ 𝐀𝐳𝐮𝐫𝐛𝐥𝐚𝐮 学生実験でお馴染みのアニリンからp ニトロアニリンを作るときのアセトアニリドの ニトロ化と同じようにできるでしょう もちろん反応熱で温度が上がりすぎてしまうとジニトロ体が生じたり 脱アシル化でアニリンになっての


ニトロアニリン 1


ニトロ化反応の条件とやり方 ネットdeカガク


有機反応機構 芳香族求電子置換反応


芳香族化合物のモノニトロ化
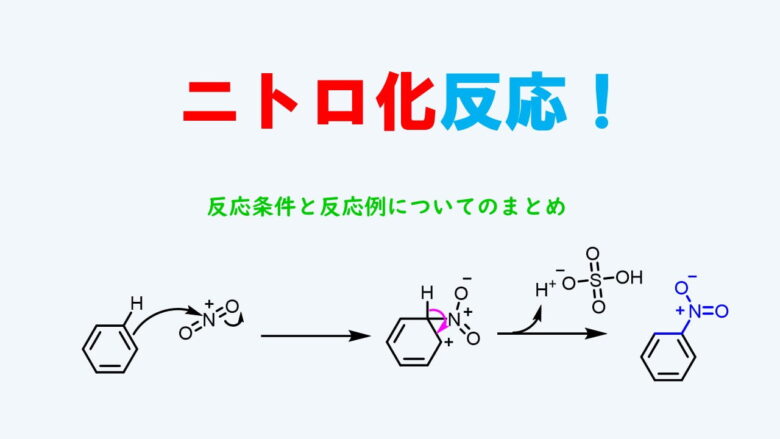


ニトロ化反応の条件とやり方 ネットdeカガク


ニトロ化反応の条件とやり方 ネットdeカガク


ここに フェノールのニトロ化はオルト パラ配向性であると書かれ Yahoo 知恵袋



有機反応を俯瞰する ー芳香族求電子置換反応 その 2 Chem Station ケムステ
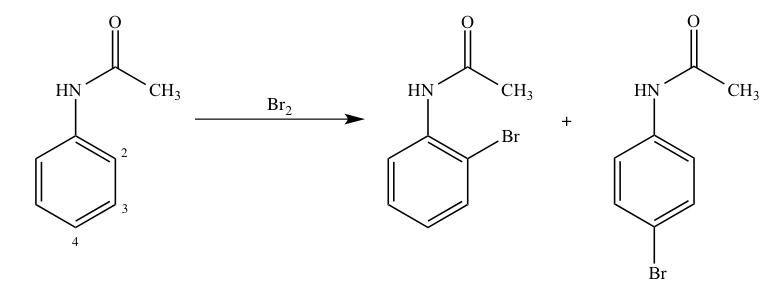


アセトアニリド ニトロ化 人気のある画像を投稿する


Pトルイジンのニトロ化について質問ですpトルイジンはpアセト Yahoo 知恵袋
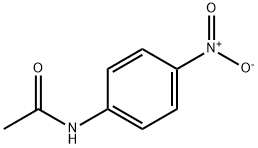


4 ニトロアセトアニリド 104 04 1
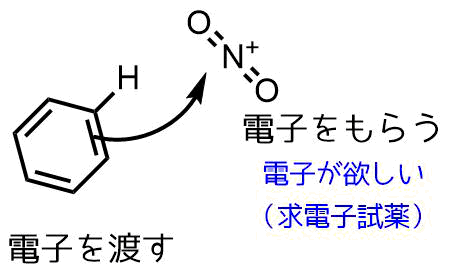


ニトロ化反応の条件とやり方 ネットdeカガク



吸光度測定で4 ニトロアニリンを用いて 質問失礼します 吸光度 化学 教えて Goo



ニトロ化反応 P ニトロアニリンの合成 Youtube


化学有機アセトアニリドに希硫酸を加えると加水分解して酢酸とア Yahoo 知恵袋
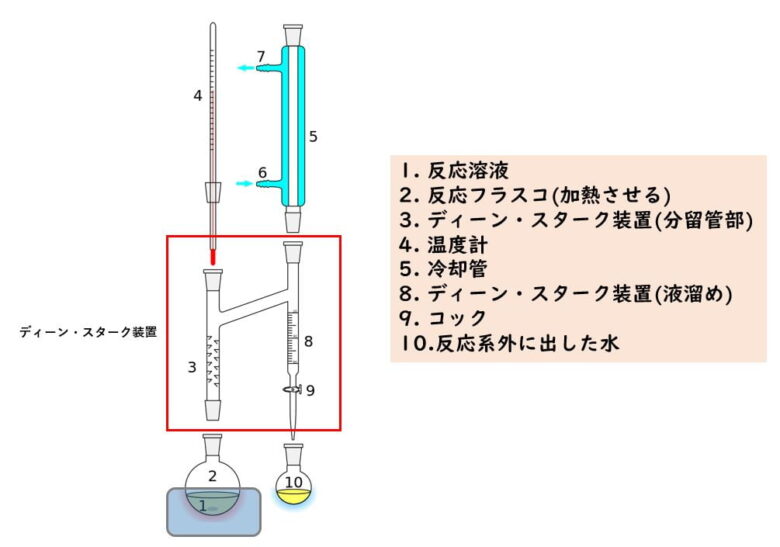


ニトロ化反応の条件とやり方 ネットdeカガク


有機反応機構 芳香族求電子置換反応


有機反応機構 芳香族求電子置換反応


有機反応機構 芳香族求電子置換反応
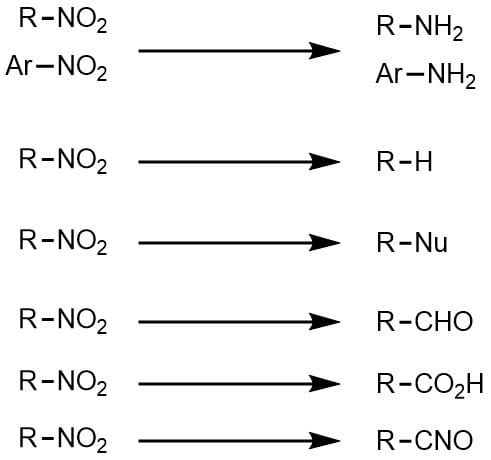


ニトロ化反応の条件とやり方 ネットdeカガク
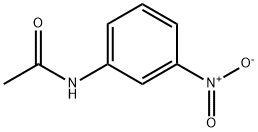


3 ニトロアセトアニリド 122 28 1


ニトロ化反応の条件とやり方 ネットdeカガク


ニトロアニリン 4


ニトロ化反応の条件とやり方 ネットdeカガク


アニリンのニトロ化の反応機構を教えてください その質問 Yahoo 知恵袋



アニリンのニトロ化 アニリンをニトロ化する際 直接ニトロ化するので 化学 教えて Goo



Wo05 0905号 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Astamuse



Comments
Post a Comment